n – Главное квaнтовое число – определяет полную энергию электрона, степень его удаления от ядра и является номером энергетического уровня. Соответствуя разрешенным (дискретным, квантовым) значениям энергии, n может принимать любые целочисленные значения, начиная с 1:  обозначения n).
Максимальное значение числа n для электронов атома в основном (невозбуждённом) состоянии равно номеру периода элемента этого атома в Периодической системе.
обозначения n).
Максимальное значение числа n для электронов атома в основном (невозбуждённом) состоянии равно номеру периода элемента этого атома в Периодической системе.
ℓ – Орбитальное (азимутальное или побочное) квантовое число – характеризует форму орбитали и подуровень энергетического уровня, задаваемого главным квантовым числом n. Орбитальное число принимает целочисленные значения от 0 до
s (sharp) — резкая,
p (principal)— главная,
d (diffuse) — диффузная,
f (fundamental) — фундаментальная,
g и далее — по алфавиту., принятые для обозначения энергетических подуровней и атомных орбиталей:

Каждому значению ℓ соответствует атомная орбиталь характерной формыГеометрическая форма атомной орбитали зависит от амплитуды волновой Ψ-функции и определяется как область пространства по квадрату модуля этой функции |Ψ|2., размеры которой увеличиваются с увеличением числа n:
s-орбиталь (ℓ = 0) – форма сферического слоя;Форма s-АО
а – 3D-модель; б – плоскость среза АО;
• – ядро атома.
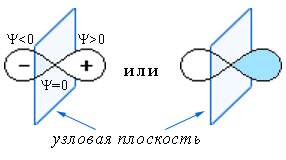
p-орбиталь (ℓ = 1) – форма объёмной восьмёркиОрбиталь рy : два лепестка, разделённые узловой плоскостью (схема);Схематическое изображение p-АО
: два лепестка, разделённые узловой плоскостью (схема);Схематическое изображение p-АО
d-орбиталь (ℓ = 2) – форма, содержащая четыре лепестка (пример).Орбиталь dxy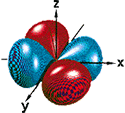
Орбитали f (ℓ = 3), g (ℓ = 4) и т.д. имеют более сложные геометрические формы.
Чем выше ℓ, тем больше узлов и тем выше энергия орбиталей данного подуровня.
ℓ=0 (s-АО) - нет узловых поверхностей;
ℓ=1 (p-АО) - одна узловая плоскость;
ℓ=2 (d-АО) - две узловых плоскости и т.д. на соответствующем ℓ-подуровне одного энергетического уровня n:
m (mℓ) – Магнитное квантовое число – определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Значения m изменяются от –ℓ до +ℓ, включая 0. Таким образом, число АО на одном ℓ-подуровне, отличающихся пространственной ориентацией, равно 
Все три р-АО имеют равную энергию и находятся на одном р-подуровне главного n-уровня. Эти АО отличаются значениями числа m (–1, 0, +1) и имеют разную пространственную ориентацию. занимающих р-подуровень.
Значению ℓ = 2 соответствуют пять d-орбиталей (d-подуровень), а при ℓ = 3 – семь f-орбиталей (f-подуровень).
- Квантовые числа n, ℓ и m, взятые вместе, описывают некоторую определенную атомную орбиталь.
Спиновое квантовое число s (ms) характеризует не орбиталь, а свойство самого электрона – его собственный момент импульса, называемый спином (от англ. spin – вращение). Квантовое число s может принимать лишь два возможных значения +1/2 или 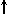 и
и 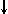 .
.
| n | ℓ | m | Число АО | Обозначение АО |
| 1 | 0 | 0 | 1 | 1s |
| 2 | 0 1 |
0 –1, 0, 1 |
1 3 |
2s 2p |
| 3 | 0 1 2 |
0 –1, 0, 1 –2, –1, 0, 1, 2 |
1 3 5 |
3s 3р 3d |
| 4 | 0 1 2 3 |
0 –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
1 3 5 7 |
4s 4p 4d 4f |
| ... | ... | ... | ... | ... |
Набор значений квантовых чисел, характеризующих электронную оболочку атома, определяется положением элемента в Периодической системе. Номер периода в физическом смысле означает:
- число энергетических уровней (электронных слоев) в электронной оболочке атомов элементов данного периода;
- номер высшего по энергии (внешнего) электронного уровня;
- главное квантовое число n для электронов на внешнем уровне.
- Для каждого предшествующего энергетического уровня в порядке понижения энергии значение числа n уменьшается на 1 до
n = 1. - Число n любого энергетического уровня позволяет найти:
- число подуровней n-уровняЭнергетические уровни (n) и подуровни (nℓ) электронной оболочки
в атомах элементов 3-го периода
- набор значений орбитальных (ℓ) и магнитных (m) квантовых чисел для описания АО;
- число АО на nℓ-подуровне (по формуле 2ℓ + 1). - Количество АО на энергетическом n-уровне равно n2.
Атомы элементов 1-го периода (Н, He) имеют одну 1s-АО на первом энергетическом электронном уровне 
Три 2р-АО с разной пространственной ориентацией (2px, 2py, 2pz) имеют равную энергию и находятся на

Иллюстрация
объёмной восьмёрки (гантели), направленной по оси x, y или z.








