Следствие из закона Авогадро:
В частности, при нормальных условиях, то есть при
Таким образом, при нормальных условиях (н.у.) молярный объем любого газа
Закон Авогадро используется в расчетах для газообразных веществ. При пересчете объема газа от нормальных условий к любым иным применяют объединенный газовый закон Бойля-Мариотта и Гей-Люссака:
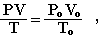
- где Рo, Vo, Тo – давление, объем газа и температура при нормальных условиях
Если известна масса (m) или количество (ν) газа и требуется вычислить его объем, или наоборот, используют уравнение Менделеева-Клапейрона:
- где ν = m/M – отношение массы вещества к его молярной массе,
R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К).
Из закона Авогадро вытекает еще одно важное следствие:

- где М1 и М2 – молярные массы двух газообразных веществ.
Величина D определяется экспериментально как отношение масс одинаковых объемов исследуемого газа (М1) и эталонного газа с известной молекулярной массой (М2). По величинам D и М2 можно найти молярную массу исследуемого газа:








