Задачи на "избыток" и "недостаток" одного из реагентов
Если реакция проводится с нарушением стехиометрических соотношений между реагирующими веществами, то полностью прореагирует вещество, взятое в "недостатке", а другой реагент, находящийся в "избытке", прореагирует не полностью. Поэтому расчет массы (объема, количества вещества) продукта реакции всегда проводят по веществу, взятому в "недостатке".
Задача. Какой объём метана (н.у.) выделится при взаимодействии 10 г карбида алюминия (Al4C3) с 10 г воды?
Краткие условия:
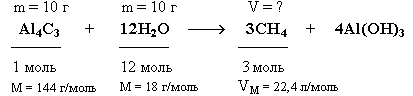
Решение
1. Находим количества вступивших в реакцию веществ:

Так как на 1 моль Al4C3 требуется в 12 раз большее количество вещества воды, то на 0,069 моль Al4C3 необходимо 0,828 моль воды. Следовательно, 0,55 моль воды недостаточно для реакции с 0,069 моль Al4C3, который взят в избытке и прореагирует неполностью.
2. Определим ν(CH4) по веществу, взятому в недостатке и полностью вступающему в реакцию:
- V(CH4) = ν(CH4) • Vm = 0,137 моль • 22,4 л/моль = 3,07 л
Ответ: V(CH4) = 3,07 л








