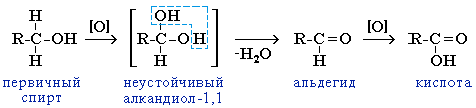

 Видеоопыт "Окисление этилового спирта оксидом меди (II)".
Видеоопыт "Окисление этилового спирта оксидом меди (II)". Видеоопыт "Окисление этанола раствором перманганата калия".
Видеоопыт "Окисление этанола раствором перманганата калия". Видеоопыт "Окисление этанола (тест на алкоголь)".
Видеоопыт "Окисление этанола (тест на алкоголь)".
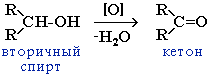
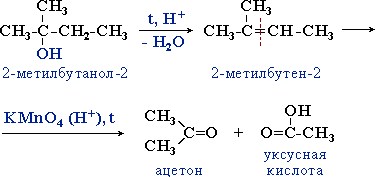
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
 2CO2 + 4H2O
2CO2 + 4H2O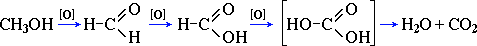
 2CO2 + 3H2O + 1370 кДж
2CO2 + 3H2O + 1370 кДжБлагодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для "спиртовок".
 Видеоопыт "Взаимодействие глицерина с кристаллическим перманганатом калия".
Видеоопыт "Взаимодействие глицерина с кристаллическим перманганатом калия".