Механизм нуклеофильного замещения в спиртах
Рассмотрим реакцию C2H5–OH + HBr  C2H5–Br + H2O.
C2H5–Br + H2O.
Замещение ОН-группы в спиртах происходит в присутствии сильной кислоты (например, H2SO4) в качестве катализатора.
Сильные кислоты – это доноры протонов (H+):
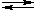 H+ + HSO4–
H+ + HSO4–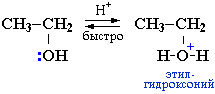
Механизм I (двухстадийный). Этот механизм обозначается как SN1 - мономолекулярное нуклеофильное замещение.
I стадия (лимитирующая). Катион алкилгидроксония, отщепляя воду, превращается в карбокатион:
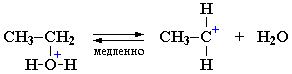
- Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–.

или 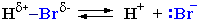
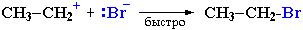
Механизм II (одностадийный). Данный механизм обозначается SN2 – бимономолекулярное нуклеофильное замещение.
Этот механизм заключается в практически одновременном отщеплении воды и присоединении нуклеофила – галогена (без образования карбокатиона) и идет в одну стадию.
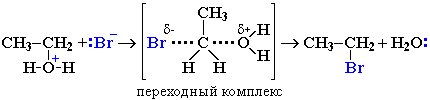
Механизм замещения зависит от строения реагентов и условий реакции.
Для третичных спиртов предпочтительней первый механизм (SN1), а для первичных – второй (SN2). Почему?
- На стадии, определяющей скорость реакции (лимитирующей стадии), в механизме I образуется карбокатион. Чем стабильнее этот катион, тем легче он образуется. Третичный катион стабильнее, чем первичный (три
С другой стороны, энергия переходного состояния в механизме II тем ниже, чем меньше стерические препятствия, то есть чем меньше алкильных групп у атакуемого атома углерода.







