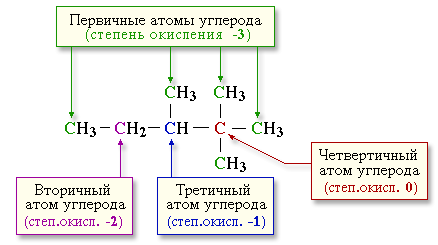
2.5.4. Реакции окисления алканов
В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные с потерей и приобретением органическим соединением атомов водорода и кислорода. Эти процессы, естественно, сопровождаются изменением степеней окисления атомов (часть I, раздел 6.4.1.6).
Окисление органического вещества – введение в его состав кислорода и (или) отщепление водорода. Восстановление – обратный процесс (введение водорода и отщепление кислорода). Учитывая состав алканов (СnH2n+2), можно сделать вывод о их неспособности вступать в реакции восстановления, но возможности участвовать в реакциях окисления.
Алканы – соединения с низкими степенями окисления углерода, и в зависимости от условий реакции они могут окисляться с образованием различных соединений.

При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят. При этом в избытке кислорода происходит их полное окисление до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С-С и С-Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
Примеры:
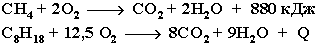
Низшие (газообразные) гомологи – метан, этан, пропан, бутан – легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
 Видеоопыт "Взрыв смеси метана с кислородом".
Видеоопыт "Взрыв смеси метана с кислородом". Видеоопыт "Горение жидких алканов".
Видеоопыт "Горение жидких алканов". Видеоопыт "Горение парафина".
Видеоопыт "Горение парафина".Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Уравнение реакции горения алканов в общем виде:
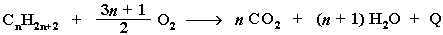
Из этого уравнения следует, что с увеличением числа углеродных атомов (n) в алкане увеличивается количество кислорода, необходимого для его полного окисления. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО2. Тогда образуются продукты частичного окисления:
угарный газ СО (степень окисления углерода +2),
сажа (мелкодисперсный углерод, нулевая степень окисления).
Поэтому высшие алканы горят на воздухе коптящим пламенем, а выделяющийся попутно токсичный угарный газ (без запаха и цвета) представляет опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
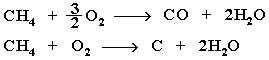
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С2-С3) получают уксусную кислоту:
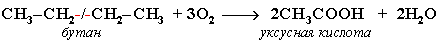
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12-С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом - "синтез-газ":

Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.