
3.1. Пиридин
Пиридин С5H5N – шестичленный гетероцикл с одним атомом азота.

Это бесцветная жидкость с неприятным запахом, т.кип. 115 °С. Хорошо растворяется в воде и органических жидкостях. Ядовит.
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp2-гибридизации. Все σ-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют π-электронную ароматическую систему.

Из трех гибридных орбиталей атома азота две образуют σ-связи С–N, а третья содержит неподеленную пару электронов, которые не участвуют в π-электронной системе. Поэтому пиридин, подобно аминам, проявляет свойства основания. Его водный раствор окрашивает лакмус в синий цвет. При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.
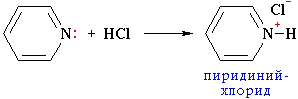
Наряду с основными свойствами пиридин проявляет свойства ароматического
соединения. Однако его активность в реакциях электрофильного замещения ниже,
чем у бензола. Это объясняется тем, что азот как более электроотрицательный элемент
оттягивает электроны на себя и понижает плотность электронного облака в кольце,
в особенности в положениях 2, 4 и 6 (орто- и пара-положения).
Поэтому, например, реакция нитрования пиридина проходит в жестких условиях

Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина.

Пиперидин проявляет свойства вторичного амина (сильное основание).