
бутанол-2
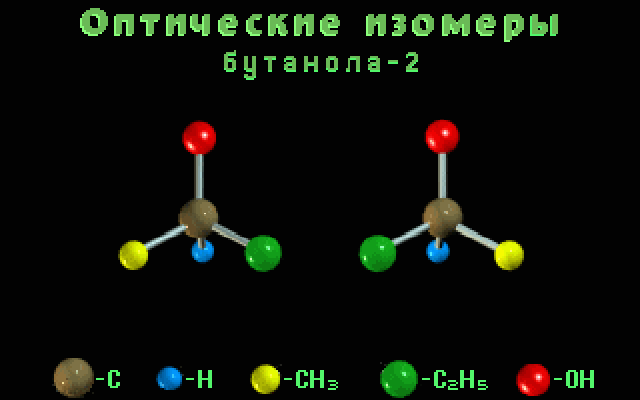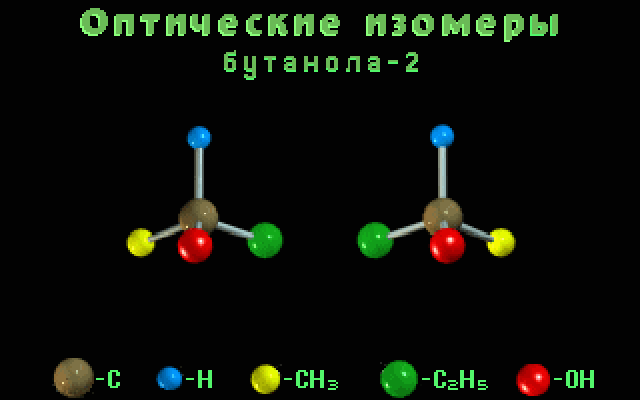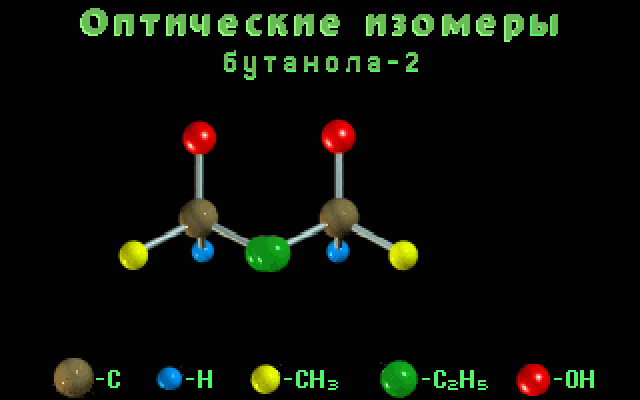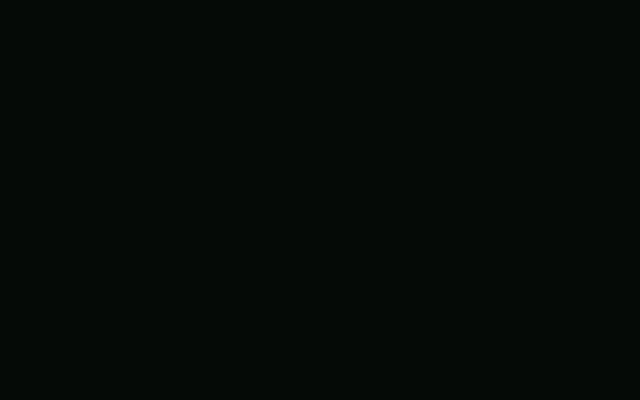
-
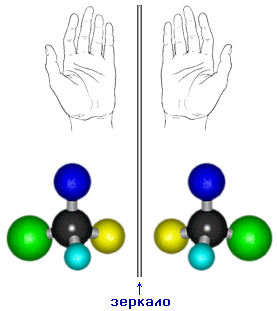
Предлагаемая VRML-модель оптических изомеров интерактивна: Вы можете заставить приблизиться правую молекулу к левой и убедиться,
что они несовместимы в пространстве (сравните положения желтых и зеленых шариков). Кроме того, можно рассматривать молекулы изомеров с трех точек зрения (вид из 3-х камер).
В обычных условиях физические и химические свойства оптических изомеров идентичны. Они имеют одинаковые температуры кипения и плавления, растворимость, плотность, показатель преломления и др. Поэтому энантиомеры нельзя разделить обычными способами — для этого требуются специальные приемы.
Отличительной особенностью физических свойств стереоизомеров этого типа является оптическая активность — способность изменять угол вращения плоскости луча поляризованного света (отсюда исторически сложившееся название — оптические изомеры). Один из энантиомеров вращает плоскость поляризации вправо, а другой — на ту же величину угла, влево. Правовращающий изоомер обозначается символом (+) перед названием соединения, а левовращающий — символом (–). Смесь равных количеств обоих стереоизомеров, называемая рацематом, оптически недеятельна и обозначается символом (±).
Различие химических свойств энантиомеров проявляется в стереоспецифичности реакций с оптически активными реагентами. Эти особенности характерны для природных энантиомерных форм биомолекул, некоторых лекарственных препаратов и их биологической активности.- Биологическая активность энантиомеров
Биологическая активность оптических изомеров (энантиомеров) В основе проявления биологической активности энантиомеров лежит стереоспецифичность химической реакции, т.е. пространственное соответствие взаимодействующих молекул (по принципу "ключ-замок"). При идентичности физико-химических свойств энантиомеров в обычных условиях их биологическая активность может быть совершенно различной.
Печальным примером служит "талидомидная катастрофа". Талидомид – лекарственное средство, которое в 60-е годы XX века врачи во многих западных странах прописывали беременным женщинам как эффективное снотворное и успокаивающее. Однако со временем проявилось его ужасное побочное действие: вещество оказалось тератогенным (повреждающим зародыш, от греческого teratos – чудовище, урод): на свет стали появляться младенцы с врожденными физическими дефектами. Причины такого действия талидомида теперь хорошо изучены. Установлено, что этот препарат является смесью двух оптических изомеров, обладающих разной биохимической активностью: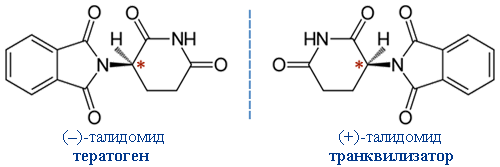
Энантиомеры талидомида
- Измерение оптической активности
Измерение оптической активности веществ Оптическая активность вещества проявляется в его способности вращать плоскость луча поляризованного света. Для измерения угла поворота плоскости поляризации используются поляриметры.
Принцип работы поляриметра заключается в следующем: испускаемый от источника (натриевой лампы) луч рассеянного света проходит через поляризатор (призмы Николя) и превращается в плоскополяризованный. Этот луч отличается от естественного тем, что колебания векторов электромагнитного поля происходят в одной плоскости, называемой плоскостью поляризации. При прохождении излучения сквозь образец, обладающий оптической активностью, происходит вращение этой плоскости.
Схема поляриметра
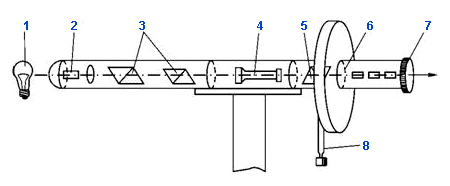
1 — источник света; 2 — дихроматический фильтр; 3 — поляризующие призмы Николя (поляризатор); 4 — кювета с раствором вещества; 5 — анализирующая призма Николя (анализатор); 6 — шкала; 7 — окуляр; 8 — рукоятка управления анализатором.
Угол вращения α, измеренный на поляриметре, зависит от толщины слоя оптически активного вещества и его концентрации в растворе, поэтому угол вращения пересчитывают на удельное вращение [α] по формуле[α] = α /(l⋅c), где l – толщина слоя жидкого вещества или раствора, дм; c – конценрация раствора, г/100 мл.
Удельное вращение зависит от природы вещества, температуры и длины волны пропускаемого через вещество света. Обычно используемая натриевая лампа даёт монохроматический свет с длиной волны 586 нм (D-линия спектра), что обозначается подстрочным индексом в выражении удельного вращения; температура измерения (например, 20 oC) указывается надстрочным индексом: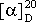 .
.







