Тип гибридизации кислорода
Электронная конфигурация
Число гибридных орбиталей
Валентный угол
sp3
1s2(2sp3
)6
4
108,5°
sp2
1s2(2sp2
)52p1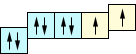
3
120°
1.2. Химические связи кислорода
Строение и, следовательно, свойства соединений кислорода определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
|
Тип гибридизации кислорода |
Электронная конфигурация |
Число гибридных орбиталей |
Валентный угол |
|
sp3 |
1s2(2sp3 )6
|
4 |
108,5° |
|
sp2 |
1s2(2sp2 )52p1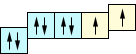
|
3 |
120° |
За счет двух одноэлектронных АО кислород способен к образованию двух ковалентных связей с другими атомами по обменному механизму. В этом случае кислород проявляет валентность 2 и имеет две неподеленные электронные пары. Такой атом кислорода может выступать донором пары электронов, образуя третью связь по донорно-акцепторному механизму. При этом кислород приобретает валентность 3 и заряд +1 (например, в ионе гидроксония H3O+ или алкилгидроксония RH2O+).
Такое взаимодействие кислородсодержащих соединений играет важную роль при проведении реакций в присутствии сильных минеральных кислот в качестве катализаторов (кислотный катализ).
Положительно заряженный атом кислорода может участвовать в образовании ионной связи. Например, в хлориде метилгидроксония:
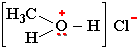
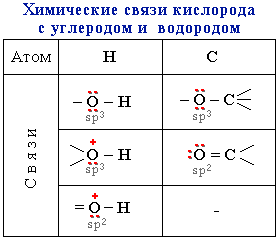
Электроотрицательности кислорода, водорода, углерода, соответственно, равны 3.5, 2.1 и 2.5. Поэтому связи кислорода с Н или С являются ковалентными полярными. В этих связях электронная плотность смещена к более электроотрицательному атому кислорода, создавая на нем частичный отрицательный заряд, а на углероде или водороде - частичный положительный.
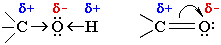
Распределение электронной плотности на атомах молекулы определяет ее реакционную способность: полярный характер связей кислорода с водородом и углеродом способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму.