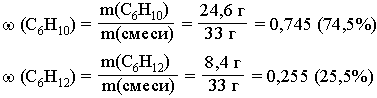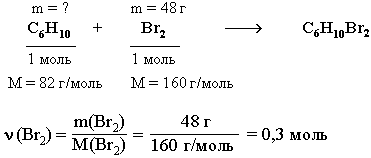 ν(С6Н10) = ν(Br2) = 0,3 моль
ν(С6Н10) = ν(Br2) = 0,3 моль
3.7. Задачи повышенной трудности
На олимпиадах и вступительных экзаменах в вузы предлагаются более сложные задачи, чем рассмотренные нами ранее. Обычно в них сочетаются различные типы расчетов – как по формулам веществ, так и по уравнениям реакций. Решение таких задач требует не только глубоких знаний химии, но и развитого логического мышления, владения алгебраическим аппаратом (системы уравнений с несколькими неизвестными, неравенства, степенные и логарифмические функции и т.п.).
Рассмотрим решение одной из олимпиадных задач (г.Самара).
Задача. При дегидрировании смеси циклогексана и циклогексена в бензол выделился водород массой, достаточной для полного восстановления 36,9 г нитробензола в анилин. Найти %-ный (по массе) состав исходной смеси, если известно, что такая же масса этой смеси может обесцветить 480 г 10%-ного раствора брома в CCl4.

1. Определим m(Br2) в растворе СCl4:
2. Из углеводородов исходной смеси с Br2 реагирует только циклогексен С6Н10, являющийся ненасыщенным соединением.
По уравнению этой реакции рассчитаем массу С6Н10.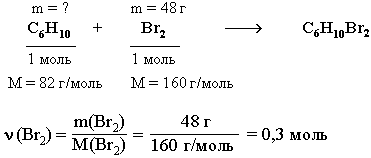 ν(С6Н10) = ν(Br2) = 0,3 моль
ν(С6Н10) = ν(Br2) = 0,3 моль
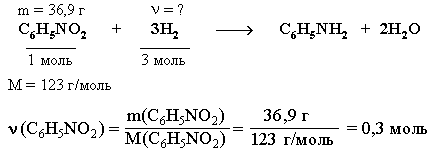 ν(Н2) = 3ν(С6Н5NO2) = 0,9 моль
ν(Н2) = 3ν(С6Н5NO2) = 0,9 моль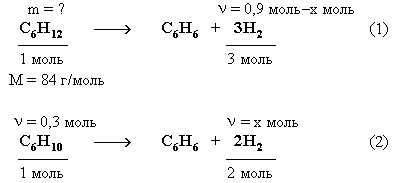
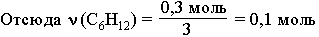
5. Определим массу исходной смеси углеводоров:
6. Рассчитаем массовые доли углеводородов в исходной смеси: