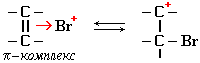Электрофильное присоединение к алкенам – механизм реакции взаимодействия электрофильных реагентов с двойной связью.
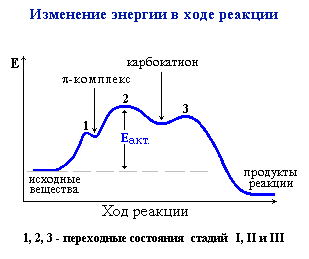
Стадии электрофильного присоединения
I стадия: образование π-комплекса. Этот комплекс возникает в результате донорно-акцепторного взаимодействияπ-электронного облака (двухэлектронной π-молекулярной орбитали) связи С=С и вакантной орбитали электрофила, например, катиона Br+:
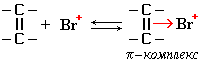 Атомно-орбитальная модель π-комплекса
Атомно-орбитальная модель π-комплекса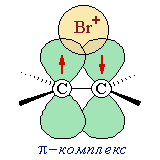
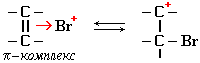

- Электрофильные ("любящие электроны") реагенты, или короче, электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на
внешнем электронном уровне (H+, CH3+, Br+, Cl+, NO2+, AlCl3 и т.п.).
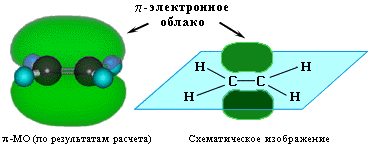
Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако π-электронов над и под плоскостью молекулы):

Стадии электрофильного присоединения
I стадия: образование π-комплекса. Этот комплекс возникает в результате донорно-акцепторного взаимодействия
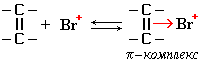 Атомно-орбитальная модель π-комплекса
Атомно-орбитальная модель π-комплекса