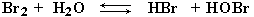
Электрофильное присоединение – механизм реакции взаимодействия электрофильных реагентов с двойной связью.
Электрофильные ("любящие электроны") реагенты, или короче, электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне (H+, CH3+, Br+, Cl+, NO2+, AlCl3 и т.п.).
Например, при пропускании этилена через водный раствор брома образование
электрофильной частицы Br+ происходит следующим образом.
В водном растворе молекула Br2 диспропорционирует по схеме:
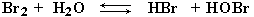
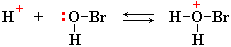
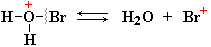
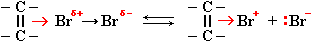
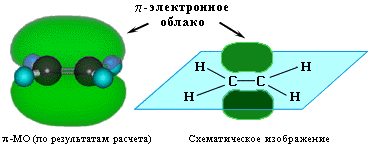
Способность алкенов вступать в реакцию с электрофильными реагентами обусловлена повышенной электронной плотностью в области двойной связи (облако π-электронов над и под плоскостью молекулы):
I стадия: образование π-комплекса. π-Электронное облако двойной связи С=С взаимодействует с электрофилом (например, Br+):
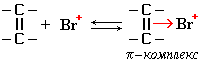
II стадия (лимитирующая): образование карбокатиона.
Электрофил (Br+)
присоединяется к одному из атомов углерода за счет электронной пары π-связи.
На втором углеродном атоме, лишенном связывающих π-электронов, появляется
положительный заряд:
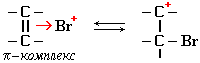
III стадия: взаимодействие карбокатиона с анионом Br-, образовавшемся
при диссоциации HBr (или Вr2), которое приводит к продукту реакции:

Изменение энергии на различных стадиях реакции показано на диаграмме.