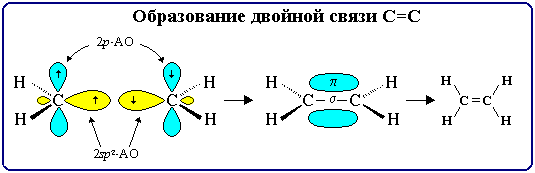
4.1. Строение двойной связи С=С
Двойная связь является сочетанием σ- и π-связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). σ-Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а π-связь – при боковом перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода (часть I, раздел 4.3.2). Образование связей в молекуле этилена можно изобразить следующей схемой:
С=С σ-связь (перекрывание 2sp2-2sp2) и π-связь (2рz-2рz)
σ-Связи, образуемые sp2-гибридными
орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула
этилена имеет плоское строение:

Модели молекулы этилена
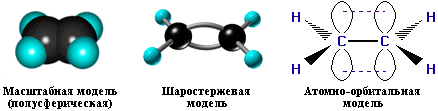
анимация (21005 байт)
По своей природе π-связь резко отличается
от σ-связи:
π-связь менее
прочная вследствие меньшей эффективности перекрывания р-орбиталей.
В молекуле пропилена
СН2=СН–СН3
в одной плоскости лежат 6 атомов:
два sp2-атома углерода и четыре связанные с ними атома
(3 атома Н и атом С группы СН3).
Вне этой плоскости находятся атомы водорода в метильной группе СН3,
имеющей тетраэдрическое строение, т.к. этот атом углерода
sp3-гибридизован.
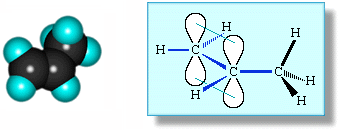
Аналогичное строение имеют другие алкены.