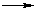 R–Y + :X –,
R–Y + :X –,Замещение галогена происходит по одному из двух возможных механизмов. Рассмотрим эти механизмы на примере замещения галогена на гидроксильную группу (гидролиз галогеноуглеводородов) в изопропилхлориде (CH3)2CH–Cl под действием водного раствора щелочи:
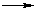 (CH3)2CH–OH + :Cl –
(CH3)2CH–OH + :Cl –Cтадия 1. Алкилгалогенид, отщепляя галоген (электролитическая диссоциация), превращается в карбокатион:
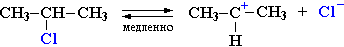
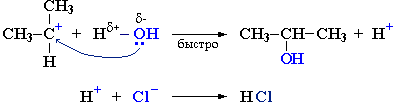
Стадия 1 является лимитирующей. Поскольку в ней участвует только одна частица (молекула галогеналкана), реакция считается мономолекулярной. Данный механизм обозначается символом SN1 (мономолекулярное нуклеофильное замещение).
Механизм II (одностадийный)Этот механизм нуклеофильного замещения заключается в практически одновременном отщеплении галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона) и идет в одну стадию:
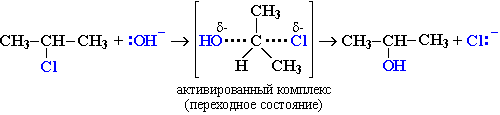
Механизм замещения зависит от строения реагентов и условий реакции. Для первичных галогеналканов предпочтительней одностадийный механизм (SN2), а для третичных – двухстадийный (SN1). Вторичные алкилгалогениды занимают промежуточное положение: механизм реакции зависит от условий ее проведения и может быть смешанным.
Как объяснить влияние строения галогеналкана на механизм реакции?
- На лимитирующей стадии в механизме I (SN1) происходит образование карбокатиона. Чем стабильнее этот катион, тем легче он образуется. Третичный катион R3C+ стабильнее, чем вторичный R2CН+ и, тем более, первичный RCН2+ (три +I-эффекта алкильных групп R в третичном катионе, два – во вторичном и один – в первичном).
- С другой стороны, энергия переходного состояния в одностадийном механизме II (SN2) тем ниже, чем меньше пространственные препятствия для его достижения, т.е. чем меньше алкильных групп у атакуемого атома углерода.







