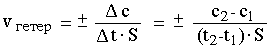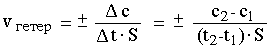
6.1.1. Скорость реакции
Скорость химической реакции - скорость изменения количества (молярной концентрации) одного из реагирующих веществ.
Скорость реакции определяется изменением количества вещества в единице объема за единицу времени, т.е. изменением концентрации Dc вещества за единицу времени Dt:
где c1 и c2 - молярные концентрации вещества в моменты времени t1 и t2, соответственно; знак "+" ставится, если скорость определяется по продукту реакции, знак "–" - по исходному веществу.
Отношение Dc / Dt характеризует скорость за какой-то промежуток времени и называется средней скоростью. Чем меньше интервал D t и изменение Dc, тем точнее отношение Dc /Dt соответствует истинной (мгновенной) скорости в данный момент. Математически это представляется в виде производной от концентрации по времени:
На скорость химической реакции, кроме природы реагирующих веществ, влияют следующие факторы:
В случае гетерогенной реакции, т.е. реакции, происходящей на границе раздела фаз между реагентами, находящимися в разных агрегатных состояниях (твердое-жидкое, твердое-газообразное и т.п.), количество реагирующего вещества относят к единице площади S межфазной поверхности: