 Примеры электронных формул:
Примеры электронных формул:

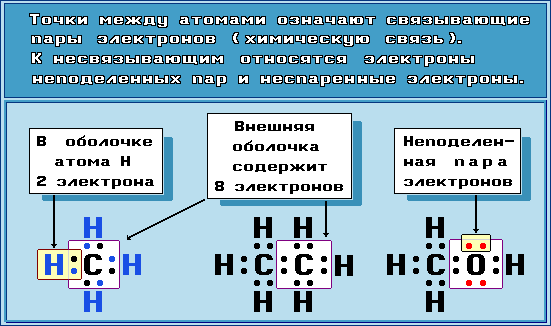
4.8. Электронные формулы молекул
Для изображения электронного строения молекул, ионов или радикалов используются электронные формулы (структуры Льюиса, октетные формулы). При написании электронной формулы должно выполняться правило октета, согласно которому атом, участвуя в образовании химической связи (отдавая или принимая электроны), стремится приобрести электронную конфигурацию инертного газа - октет (восемь) валентных электронов. Исключение составляет атом водорода, для которого устойчивой является конфигурация гелия, т.е. 2 валентных электрона.
 Примеры электронных формул:
Примеры электронных формул:

Электронные формулы молекул (а также ионов и свободных радикалов) нашли широкое применение в органической химии. Однако они не отражают пространственного строения молекул. Поэтому в тех случаях, когда необходимо иметь представление не только о распределении электронов, но и о пространственном строении органических соединений, используются атомно-орбитальные модели, которые служат основой для построения стереохимических (пространственных) формул молекул.