4.3. Гибридизация атомных орбиталей
Для объяснения пространственного строения молекул и устойчивости ковалентных связей, а также
фактов, когда атом образует большее число связей, чем число неспаренных электронов в его основном состоянии (например, атом углерода), используется постулат о гибpидизации близких по энергии атомных орбиталей. Гибридизация АО происходит при образовании ковалентной связи, если при этом достигается более эффективное перекрывание орбиталей.
Гибридизация атома углерода сопровождается его возбуждением и переносом
электрона с 2s- на 2р-АО:
Основное и возбужденное состояния атома углерода.
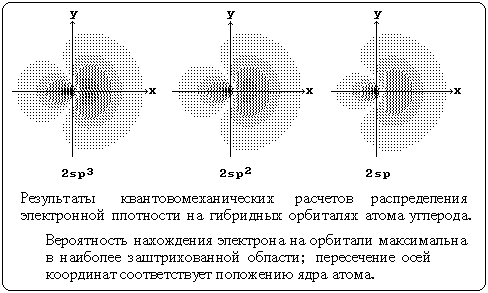
Гибридизация АО – это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
Например, смешение 2s-АО с 2p-АО дает две гибридные 2sp-АО:

- для атомов углерода и азота – sp3, sp2 и sp;
- для атома кислорода – sp3, sp2;
- для галогенов – sp3, sp2.