1.1. Углерод
Символ С, элемент IVA группы 2-го периода Периодической системы элементов; атомный номер 6; атомная масса 12,01115.Электронная конфигурация в основном состоянии 1s22s22p2.
Углерод – особый элемент. Ни один другой химический элемент не может образовывать такое многообразие соединений. Причина этого многобразия в том, что атомы углерода способны:
- соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые (управляемая анимация)
и разной длины – от двух атомов углерода (этан, этилен, ацетилен) до сотен тысяч (полиэтилен, полипропилен, полистирол, другие карбоцепные полимеры),
а также создавать разнообразные наноструктуры (фуллерены, нанотрубки, наноконусы и т.п);
- образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
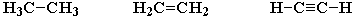
- создавать прочные связи почти с любым другим элементом.
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
- Углерод постоянно циркулирует в земной биосфере по замкнутым взаимосвязанным путям (иллюстрация).
См. Круговорот углерода в природе на elementy.ru