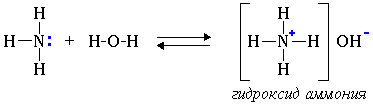
2.3.2.1. Основность аминов
Для аминов характерны ярко выраженные основные свойства (за что их часто называют органическими основаниями).
1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония: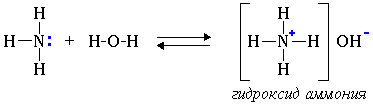
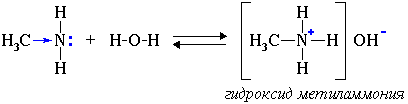
 Видеоопыт "Получение гидроксида диметиламмония и изучение его свойств".
Видеоопыт "Получение гидроксида диметиламмония и изучение его свойств".
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
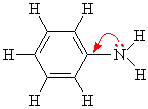
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
 или
или 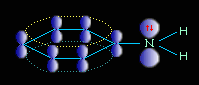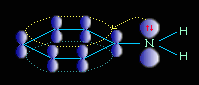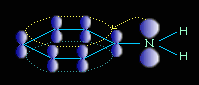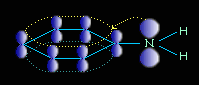
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида.
 Видеоопыт "Взаимодействие анилина с соляной кислотой".
2. Взаимодействуя с кислотами, амины образуют соли:
Видеоопыт "Взаимодействие анилина с соляной кислотой".
2. Взаимодействуя с кислотами, амины образуют соли:
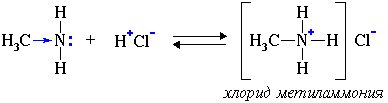
Соли аминов – твердые вещества, хорошо растворимые в воде. Щелочи (более сильные основания) легко вытесняют из них амины:

Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате
Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители
C6H5NH2 < NH3 < (CH3)3N < CH3NH2 < (CH3)2NH