6.4.3. Окисление алкинов
Ацетилен и его гомологи легко окисляются различными окислителями
(перманганатом калия в кислой и щелочной среде, дихроматом калия в кислой среде и др.).
Строение продуктов окисления зависит от природы окислителя и условий проведения реакций.
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
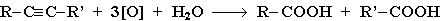 Алкины обесцвечивают разбавленный раствор перманганата калия, что используется для доказательства их ненасыщенности.
В этих условиях происходит мягкое окисление без разрыва σ-связи С–С
(разрушаются только π-связи). Например, при взаимодействии ацетилена с разбавленным раствором KMnO4
при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
Алкины обесцвечивают разбавленный раствор перманганата калия, что используется для доказательства их ненасыщенности.
В этих условиях происходит мягкое окисление без разрыва σ-связи С–С
(разрушаются только π-связи). Например, при взаимодействии ацетилена с разбавленным раствором KMnO4
при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
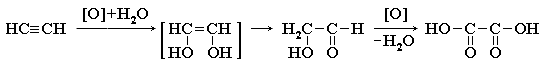
 Видеоопыт
Видеоопыт
"Взаимодействие ацетилена с раствором перманганата калия".
При сгорании алкинов происходит их полное окисление до CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
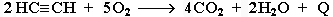
 Видеоопыт
Видеоопыт "Горение ацетилена".
Температура ацетиленово-кислородного пламени достигает
2800-3000 °С. На этом основано применение ацетилена для сварки и резки металла.
Ацетилен образует с воздухом и кислородом взрывоопасные смеси.
 Видеоопыт
Видеоопыт "Взрыв смеси ацетилена с кислородом".
В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара. Поэтому он хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест или кизельгур.
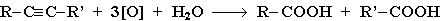
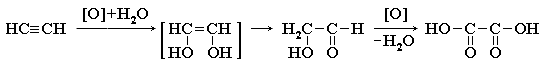
 Видеоопыт
"Взаимодействие ацетилена с раствором перманганата калия".
Видеоопыт
"Взаимодействие ацетилена с раствором перманганата калия".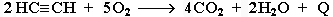
 Видеоопыт "Горение ацетилена".
Видеоопыт "Горение ацетилена". Видеоопыт "Взрыв смеси ацетилена с кислородом".
Видеоопыт "Взрыв смеси ацетилена с кислородом".