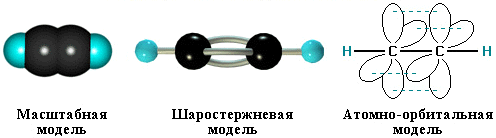
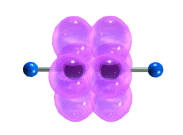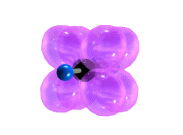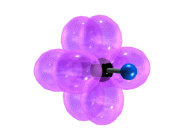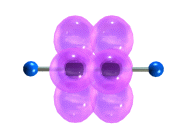
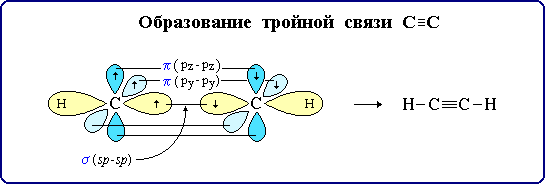
Тройная связь является комбинацией из одной σ- и двух π-связей, образуемых двумя sp-гибридизованными атомами
σ-Связь возникает при осевом перекрывании sp-гибридных орбиталей соседних атомов углерода; одна из π-связей образуется при боковом
перекрывании рy-орбиталей, другая – при боковом перекрывании рz-орбиталей. Образование связей на примере молекулы ацетилена
C≡C σ-связь (перекрывание 2sp ↔ 2sp);
π-связь (2рy ↔ 2рy);
π-связь (2рz ↔ 2рz);
С–Н σ-связь (перекрывание 2sp-АО углерода и 1s-АО водорода).
π-Cвязи располагаются во взаимно перпендикулярных плоскостях:
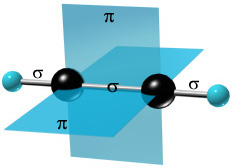
σ-Cвязи, образуемые sp–гибридными орбиталями углерода, располагаются на одной прямой (под углом 180° друг к другу). Поэтому молекула ацетилена имеет линейное строение.