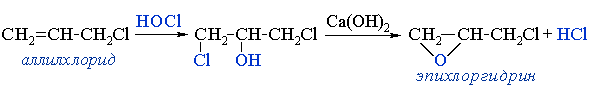Активность галогенов в реакции присоединения к алкенам возрастает в ряду: I2 < Br2 < Cl2 < F2.
Реакция с иодом идет медленно и не доходит до конца. Фтор действует агрессивно, разрывая не только π-связь, но и σ-связь
Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) или в органическом растворителе служит качественной реакцией на наличие кратной связи:
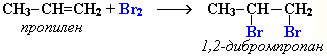
 Видеоопыт "Взаимодействие этилена с бромной водой".
Видеоопыт "Взаимодействие этилена с бромной водой".
Ещё легче присоединяется хлор:
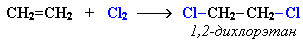
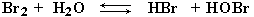
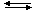 H+ + Br–) приводит к образованию большого количества катионов H+, которые взаимодействуют с неподеленными электронными парами атомов кислорода слабой бромноватистой кислоты HOBr:
H+ + Br–) приводит к образованию большого количества катионов H+, которые взаимодействуют с неподеленными электронными парами атомов кислорода слабой бромноватистой кислоты HOBr: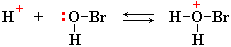
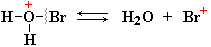
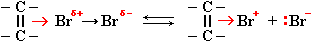
При высокой температуре происходит радикальное замещение атома водорода при соседнем к двойной связи атоме углерода (реакция Львова):
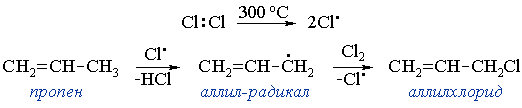
Подробнее
С другой стороны, двойная связь С=С влияет на реакционную способность соседней алкильной группы, определяя подвижность атома водорода в этой группе.
• В условиях, способствующих радикальным реакциям, возможен гомолитический разрыв связи
Такие реакции называют радикальным аллильным замещением.
• При высокой температуре пропен реагирует с хлором, образуя аллилхлорид – продукт радикального замещения атома водорода в группе CH3 (реакция SR):
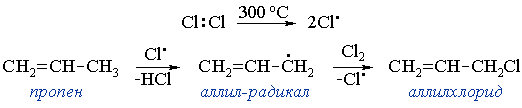
Это одна из стадий промышленного синтеза глицерина
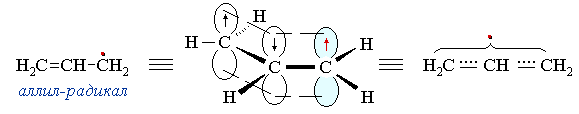
В общем случае делокализация неспаренного электрона в радикалах аллильного типа отражается граничными структурами:
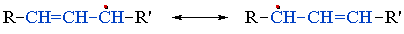
Эта реакция используется в промышленных синтезах. Например, из аллилхлорида получают:
- глицерин
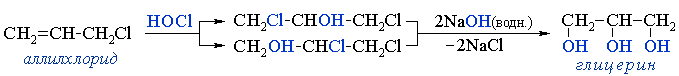
Аллилхлорид присоединяет хлорноватистую кислоту HОCl с образованием дихлорпропанолов CH2ClCH(OH)CH2Cl
и/или HOCH2CHClHCH2Cl, которые при щелочном гидролизе превращаются в глицерин HOCH2CH(OH)CH2OH. - эпихлоргидрин — необходимый полупродукт в производстве эпоксидных смол,Эпоксидные смолы — продукты поликонденсации эпихлоргидрина с фенолами, чаще всего — с бисфенолом А. Это полимеры с невысокой молекулярной массой (олигомеры), содержащие эпоксидные группы и способные под действием отвердителей (полиаминов и др.) образовывать сшитые полимеры. Смолы и композиционные материалы на их основе широко применяются в различных отраслях промышленности, популярны в декоративно-прикладном творчестве..